글로벌제약사 잇따른 임상 실패 불구 도전 계속
전 세계적인 고령화 추세로 치매환자가 증가하고 있으나 치료제 개발은 난항을 겪고 있다. 글로벌제약사들이 시장성과 잠재력이 높은 치매치료제 개발에 나서고 있으나 치매 치료제 개발은 성공률이 매우 낮은 것으로 분석되고 있다. 일반적으로 신약 후보물질의 성공가능성이 10% 내외라고 보고되고 있으나 치매치료제의 최종 허가 성공률은 1%에도 미치지 못한다는 지적이다. 2003년 이후 미국 FDA 승인을 받은 치매 치료 신약이 없는 실정이다.
지난해말과 올초에도 치매치료 신약 후보물질로 기대를 모았던 일라이 릴리의 소라네주맙과 MSD의 베루베세스타트가 잇따라 3상 임상이 중단되며 신약 개발의 어려움을 다시 한번 확인시켰다.
퇴행성뇌질환 등 여러 원인에 의해 인지기능이 저하되는 치매 유형에는 알츠하이머를 비롯 혈관성 치매, 루이체 치매, 파킨슨병 치매, 전측두엽 치매 등이 있다.
2015년 기준 국내 65세 이상 인구 치매유병률은 9.8%(약 64.8만 명)로 집계됐으며, 중앙치매센터에 따르면 국내 치매환자 수는 2024년에 100만 명을 넘어설 것으로 예상된다. 국내 65세 이상 치매환자 4명 중 3명은 알츠하이머형 치매인 것으로 나타나고 있다.
GBI Research에 따르면 글로벌 알츠하이머병 환자는 2014년 약 785만 명으로, 2021년까지 17% 이상 증가해 약 920만 명에 이를 것으로 전망된다. 경도 인지장애 인구 약 3,630만 명까지 합하면 환자 수는 4,400만 명 이상으로 늘어난다.
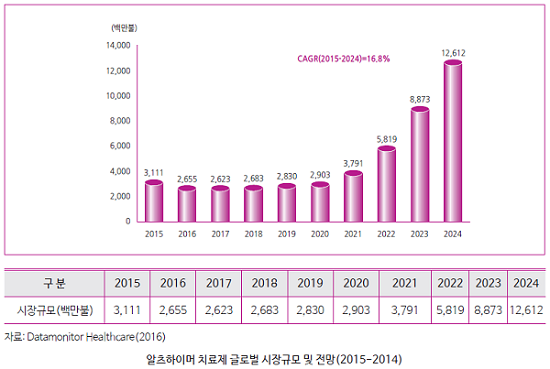
Datamonitor Healthcare 자료에 따르면 2015년 알츠하이머병 치료제의 글로벌 시장규모는 약 31.1억불로, 2024년까지 4배 이상 성장해 약 126.1억불의 시장을 형성할 것으로 예상된다. 고령화로 인해 유병률이 증가하고, 진단기술이 발달하면서 치료제에 대한 수요도 늘어날 전망이다.
국내 알츠하이머형 치매치료제 시장(보험급여 청구액 기준)은 2016년 약 2,155억 원 규모로 5년 전에 비해 120% 정도 증가했으며, 65세 이상 환자가 96%를 차지하고 있다.
치매치료제 5개..증상 완화 뿐 근본치료제 없어
지금까지 승인된 치매 치료제는 고작 5개로 치매 증상을 완화시키는 약일 뿐 근본 치료제는 없는 실정이다.
미국에서는 2003년 이후 FDA 승인을 받은 치매 치료 신약이 없는 실정이다.
가장 최근 FDA 허가를 받은 품목은 기존성분인 AChEI인 ‘Donepezil’과 NMDA 수용체 길항제인 ‘Memantine ER’ 복합제 ‘남자릭(Namzaric)’으로 '14년 허가됐다.
알츠하이머병의 정확한 발병 기전과 원인에 대해서는 정확히 알려져 있지 않다. 뇌 속에 존재하는 아밀로이드베타(Aβ) 단백질과 타우(Tau) 단백질의 응집 등 이상 현상이 병리적 특징으로 관찰되고 있다.
현재 시판되고 있는 알츠하이머병 치료제는 신경전달물질인 아세틸콜린의 분해를 막는 ‘AChE 억제제’와, 글루탐산이 수용체와 결합하여 과도하게 활성화되는 것을 막는 ‘NMDA 수용체 길항제’로 분류되고 있다.
1996년 FDA 승인을 받은 대표적인 알츠하이머 치료제인 아리셉트(AChE 억제제)는 2009년 40억불 이상의 매출을 거두며 블록버스터 약물로 자리매김했으나, 특허만료에 따른 제네릭 출시와 엑셀론 등 타 제품과의 경쟁으로 오리지널 제품의 시장규모는 점차 감소하고 있다.
2000년 FDA 허가를 받은 엑셀론은 아리셉트와 같은 AChEI 물질이지만, 동시에 BChEI(Butyrylcholinesterase Inhibitor)로도 작용하는 것으로 보고되고 있다. 캡슐로 개발됐으나 2007년 1일 1회 부착하는 패취제가 개발되어 사용이 편리해졌다.
나멘다는 1960년대 일라이 릴리에 의해 당뇨병치료제로 개발됐으며, 이후 Merz Pharma가 알츠하이머 치료에 대한 효능을 입증하면서 2003년 FDA의 승인을 받았다. 경구투여 약물로 경증~중등도 환자의 치료제 주로 쓰이며, 뇌에 있는 NMDA 수용체의 비선택적 길항제로 작용한다. Memantine 성분의 이 약물은 독일에서 1989년 치매치료제인 ‘Axura’로 시판됐으며, 2000년에 룬드벡의 ‘Ebixa’로 시판됐다.
2003년 이후 FDA 승인 치매치료신약 없어
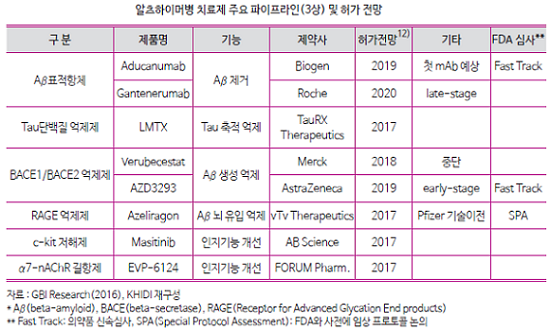
보건산업진흥원은 '알츠하이머병 글로벌 시장 분석'을 통해 그동안 AChEI 등 신경전달물질 농도를 일시적으로 상승시켜 인지 개선효과를 보이는 치료제가 중심을 이루었다면, 최근에는 아밀로이드베타(Aβ), 타우(Tau) 단백질을 타깃하는 파이프라인 비중이 높아지고 있다고 소개했다. 파이프라인의 약 30%는 바이오의약품이며, 펩타이드 및 단일클론항체의 비중이 높은 것으로 나타나고 있다.
임상3상 단계의 글로벌 주요 파이프라인 중 아밀로이드베타(Aβ)를 타겟팅하여 제거하는 기전의 항체치료제가 향후 알츠하이머병 치료제 시장 성장에 가장 큰 기여를 할 것으로 전망되고 있다. 이와관련 바이오젠과 로슈가 3상 임상을 진행하고 있다.
타우 단백질 축적을 억제하는 물질, BACE(beta-secretase)를 저해하는 기전의 후보물질 개발도 활발히 이루어지고 있으며, 일부 파이프라인은 5년 내 시판을 기대하고 있다.
First-in-class로 2018년경 허가를 전망했던 머크의 베루베세스테트는 지난 2월 임상3상을 중단했으나 증상이 없거나 미약한 초기단계 환자를 대상으로 하는 별도 임상시험은 계속 진행한다는 방침이다.
일라이릴리와 아스트라제네카가 함께 개발 중인 AZD3293는 '16년 8월 FDA Fast Track 대상으로 선정됐고, 바이오젠-에사이의 BACE 억제제 E2609는 지난해 FDA 임상 3상이 허가됐고, 암젠-노바티스의 CNP520, GSK의 GSK933776 등도 임상을 진행중이다.
국내사, 패취제 등 새로운 제제 개발
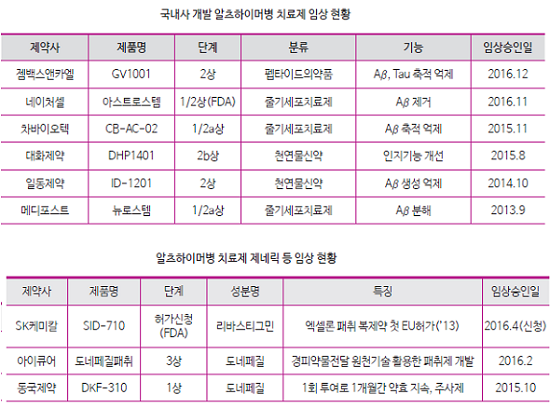
국내 제약사도 천연물신약, 줄기세포치료제, 펩타이드의약품 등 알츠하이머병 치료제 개발에 나서고 있으며, 대부분 임상1상 혹은 2상 단계에 있다.
젬백스앤카엘이 펩타이드의약품, 네이처셀 차바이오텍 메디포스트가 줄기세포치료제, 대화제약과 일동제약이 천연물신약 치매치료제 임상에 나서고 있다.
동아쏘시오는 2013년 동아치매센터를 설립하고 치매 관련 연구에 주력하고 있다. 천연물 소재로 베타아밀로이드의 생성을 억제하는 ‘DA-9803’은 본격적인 미국 임상이 시작될 것으로 기대된다. 메디포스트는 치매와 뇌종양 등 뇌신경계 분야에서 총 30개의 특허를 보유하고 있다.
오리지널제품의 순응도와 안전성을 높이기 위한 새로운 제제개발(패취제, 주사제 등)을 통해 차별성을 갖춘 제네릭 개발도 진행되고 있다.
SK케미칼의 엑셀론 패취 제네릭이 '13년 EU 허가를 받은데 이어 '16년 4월 미FDA에 허가를 신청해 미국시장 진출이 기대되고 있으며, 아이큐어는 경피약물전달 원천기술을 활용한 도네페질 패취제 개발을 추진하고 있다.
제약바이오업계는 치매치료제 개발을 위한 다각적인 협력에도 나서고 있다. 젬백스앤카엘은 글로벌 CRO 및 제조업체와 계약을 통해 글로벌 임상을 추진하고 있고, 메디프론은 스위스 로슈사와 RAGE억제제 신약후보물질 공동연구 및 기술이전 계약을 체결했다. 대웅제약은 메디프론의 신약 후보물질 ‘DBT-1339' 공동 연구개발 계약을 맺기도 했다. 동화약품은 UNIST(울산과학기술원)과 치매치료제 산업 육성을 위한 MOU를 체결했고, CJ헬스케어는 ‘바이오 헬스케어 펀드’를 통해 치매치료제 개발 바이오벤처에 투자하고 있다.