금감원, 모범사례 마련 3분기 보고서부터 적용
제약·바이오 산업에 대한 투자자들의 관심이 급증하고 있으나 관련기업의 중요 정보 및 위험에 대한 공시내용은 불충분하다는 지적이다.
이에따라 금융감독원은 제약·바이오 산업 특유의 투자위험요소들에 대한 정보를 사업보고서에 체계적이고 상세히 기재토록 모범사례를 마련하고 ‘18년 3분기 보고서부터 적용할 방침이다.
신약개발 관련 내용은 ‘연구개발활동’, 라이센스계약은 ‘경영상의 주요계약’ 부분에 집중해 정보접근 편의성을 제고했다. 또한 중요정보 파악 및 비교가 용이하고, 중요내용이 누락되지 않도록 기재항목들을 명시한 서식(표)을 제시했다.
금감원은 또한 투자자보호를 위해 제약·바이오 산업 특유의 위험 요소를 소개하고 주의를 당부했다.
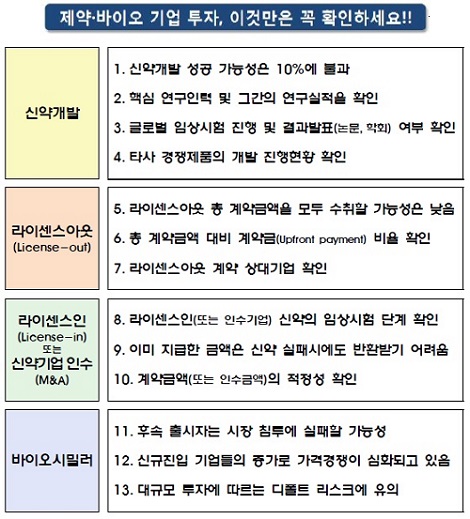
국내 제약사들은 임상실패 및 개발 중단의 경우에도 이를 공개하지 않는 경향이 있어, 실패 여부를 확인하기 어려운 상황이라고 지적했다. 실제로 '13년~ '16.6월까지 임상시험 중단보고 건수는 166건으로, 같은 기간 임상시험 계획 승인 건수(2,230건)의 7.4%에 불과한 것으로 나타났다.
또한 글로벌 제약사의 트렌드에 부합하지 않는 신약은 기술수출(License-out) 및 개발 성공에 따른 수익창출 가능성이 낮은 것이 현실이다.
바이오시밀러의 경우 신약에 비해 진입장벽이 상대적으로 낮아 신규 진입 회사가 증가하고 있으며, 가격경쟁이 치열하다. 특히 대량 생산을 위한 대규모 설비투자가 불가피해 예상만큼 수익이 발생하지 않을 경우 기업의 존속 자체가 위험할 수도 있다.
금감원은 현행 공시내용으로는 제약·바이오 산업 특유의 위험에 대한 확인이 어려운 실정이라고 지적했다.
특히, 임상실패 및 개발중단 등의 정보를 기재하지 않아 신약개발의 실패 여부를 확인하기 어려운 실정이다.
경영상 중요한 라이센스 계약의 경우 매출계약 등 성격이 다른 계약과 같이 기재되어 있고, 리스크 파악에 쉽지 않다. 사업보고서의 다른 부분(회사 연혁 등)에 기재해 정보파악이 어렵거나, 계약이 체결됐음에도 기재하지 않은 회사들도 있다.